MgSO4与NaCl的水溶液蒸发结晶后会不会得到MgCl2和NaSO4,为什么?
MgSO4与NaCl的水溶液蒸发结晶后会不会得到MgCl2和NaSO4,为什么?
问题补充: 是什么原因?
想明白这一问题首先要对晶体的结晶过程有初步的了解,结晶(Crystallization)是分子(原子,离子)按一定的空间次序排列而形成的固体的过程。物质从溶液中析出的过程,可分为晶核生成(成核)和晶体生长两个阶段,两个阶段的推动力都是溶液的过饱和度。例如如下溶解度曲线图1,不稳定区能自发的产生晶核,介稳区则不会自发的产生晶核,而稳定区不会进行结晶,所以想获得物质的晶体需要使溶液处于过饱和状态。
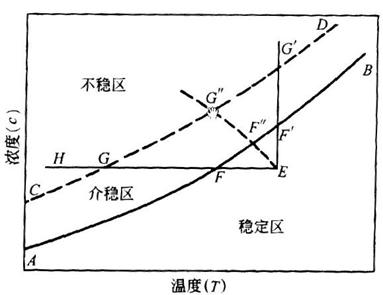
图1 溶解度曲线
使溶液达到过饱和状态常用的方法有如下几种:
1. 冷却结晶,适用于溶解度随温度升高而增加的体系,通过相图我们可以看出,温度降低其溶解度急剧下降从而达到过饱和的状态,实验室中的具体操作就是程序降温或者直接扔到冰箱里冷冻。
2. 溶剂挥发,适用于溶解度随温度变化不明显的体系,有机物质和金属配合物常用这种方法结晶,很多有机物质在纯度很高时都可以通过这种方法获得配合物结晶,而单晶结构要比核磁,质谱获得的结构更加直观和清洗,所以近些年结晶学在有机合成化学领域也得到了广泛的应用。
3. 改变溶剂的极性,例如A物质在甲醇中溶解度极好,而在乙醚中溶解度并不好,这样通过改变溶剂的极性也可以使A物质结晶,这个方便在无机化学领域被广泛应用,成为惰性溶剂扩散法。
4. 高温高压反应法,很多人也叫他水热合成法,该方法是利用温度升高物质溶解度增加的方式,在高温高压的状态下使底物反应生产目标产物,在程序降温时体系达到过饱和状态从而使目标产物的晶体缓慢析出的过程,该方法在一些新兴的领域如多孔材料,Mof和多酸合成中广泛应用。
5. 直接反应法,如A物质溶解于甲醇溶液中,B物质溶解于二氯甲烷溶液中,将两个溶液缓慢混合,在溶剂界面处发生化学反应从而获得物质单晶,这种方法操作难度较大,要求混合速度控制合理,并要求对所研究的体系有足够的了解。
但是实际实验的时候除了这些基础的方法,还可以将多个方法组合,例如我曾经用低温挥发的方法和低温下扩散的方法获得了配合物的单晶,所以结晶的过程也是对反应体系了解的过程。
说完了形成晶核的过程,相信你对结晶也有了初步了解,接下来回答你提出的具体问题。我做了四个无机盐的溶解度曲线图2来帮助你分析这个问题,首先水溶液中主要有四种自由离子分别为Mg+,Na+,SO42-和Cl-,而这四种自由离子可随意组合生产分子。通过以下曲线我们可以看出四个物质的溶解性的敏感度对温度有明显的差异,因此你提出的问题缺少一个特定的温度条件。比如在40度时氯化钠会先达到过饱和状态,其次为硫酸镁,硫酸钠最后为氯化镁。而在二十度时,硫酸钠会先达到过饱和状态,因此先结晶析出,而后是硫酸镁和氯化钠,最后为氯化镁。所以想要获得某一种物质的结晶情况应根据相图具体分析,再设置相应实验。
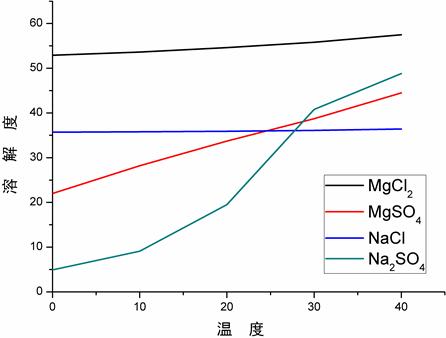
图2 四种无机盐的溶解度曲线
最后附上我最近获得的一个晶体,也希望自己接下来的科研工作会更加顺利,如需相关晶体学学习材料或有什么问题可以与私下联系与讨论。

2017,11,20
永远不要把化学想得太简单。
因为这两种盐是完全电离的,所以在水溶液中存在四种离子,Mg+、Na+、SO4-、Cl-离子(不考虑水的电离氢氧根和氢离子)。
因此可以相互组合成四种盐:MgSO4、MgCl、NaCl、NaSO4.
当然这四种盐的溶解度不一样:



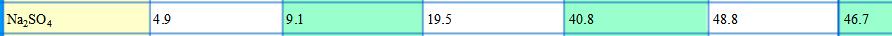
当水溶液蒸发时,假如在40℃。由于氯化钠的溶解度在此温度下最小,所以最先析出氯化钠晶体,然后会析出硫酸镁,硫酸钠和氯化镁晶体。
因此答案是可以得到四种盐的混合物,当然如果想提纯,可以控制温度,逐一析晶,重复几次就可以得到较纯的晶体了。
应该能够得到氯化镁和硫酸钠,这是新物质,但不是复分解反应得到。溶液中发生复分解反应,一般要求气体和沉淀产生,是在以溶液为反应状态。现在反应条件发生改变了,产生新物质也可以接受。

